2020年8月欧盟医疗器械协调小组MDCG发布了关于在欧盟成员国境内使用EUDAMED和SRN的指导文件:MDCG2020-15

文件透露MDCG已经于2020年3月12日同意将EUDAMED各个模块分开独立上线运行,其中的Actor registration模块将于2020年12月1日上线运行。
届时,经济运营商可以通过此模块申请单一注册号(SRN)。
由于关于EUDAMED相关要求的适用时间,在法规条文上并没有进行修订,在EUDAMED全部模块就位通知发布后6个月前,此项申请应该还是自愿性的。
但因为MDCG强烈建议相关方注册并应用SRN,公告机构可能会在此模块上线后,要求其认证客户尽早完成相应的申请。
EUDAMED全部功能的运行预计将在2022年5月份实现。
二、根据MDR和IVDR法规的描述,EUDAMED应包含以下七个电子系统:
1、器械注册电子系统
2、UDI数据库
3、经济运营商注册电子系统
4、公告机构和证书电子系统
5、性能研究电子系统
6、警戒和上市后监管电子系统
7、市场监管电子系统
三、如何实施:
相关经济运营商(EO)包括制造商、授权代表、进口商、经销商,都要求使用这个SRN注册模块。
对于企业,在向公告机构申请符合性认证、访问 Eudamed、现场安全通告、安全和临床性能、欧盟符合性声明和向 UDI 数据库登记UDI时都需要使用在Eudamed注册后获得的SRN(单一注册号)。
在Eudamed中注册的信息需要在注册1年内进行一次准确性确认,且此后每2年需要再确认。
信息应按MDR附录VI,晚需要在Eudamed正式发布或者法规过渡期结束后18个月的过渡期内完成注册。
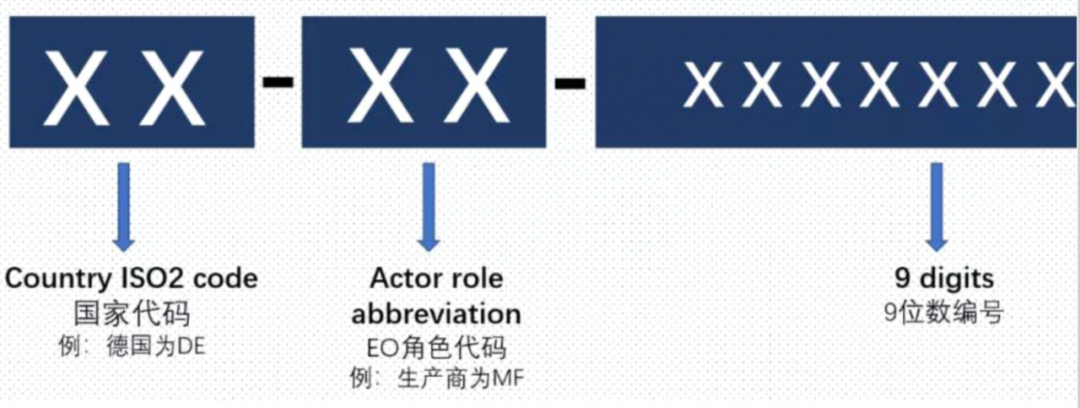
SRN 单一注册号
Single Registration Number
按照MDR第30条第1款要求,注册功能模块会生成MDR第32条第2款提及的的单一注册号(SRN)。
MDR第31条第2款规定,成员国主管当局在核实和确认申请者数据后,会通过Eudamed注册功能模块中获取SRN,并将其提供给制造商、欧代或进口商。
一个EO角色对应一个SRN。
每一个SRN中也会体现该编号对应的角色。
-SRN编号组成
文件需求(按官方模板)
A·信息安全责任宣言
所有参与者必须上载已签署的信息安全责任宣言
B·授权摘要文件
要在EUDAMED中进行注册,非欧盟制造商必须拥有有效的授权代表
并随注册一起提交授权摘要文件
SRN注册申请中,除了要准备以上两个文件,还需要准备组织识别支持文件,根据相关主管当局发布的SRN FAQ文件[4],合规负责人的资质证明在注册过程中,也可能也会被要求提供。
注册流程(以企业的经营者为例)
01、制造商将注册申请递交给授权代表
02、授权代表验证注册请求
03、授权代表将验证通过的注册申请递交给主管当局
04、主管当局对注册申请进行审核评估
05、批准注册请求后将由主管当局生成核发登记证明书,Eudamed通过电子邮件将SRN发送给制造商